Biofilm – Source constante de micro-organismes et potentiellement de pathogènes
Qu’est-ce que le biofilm ?
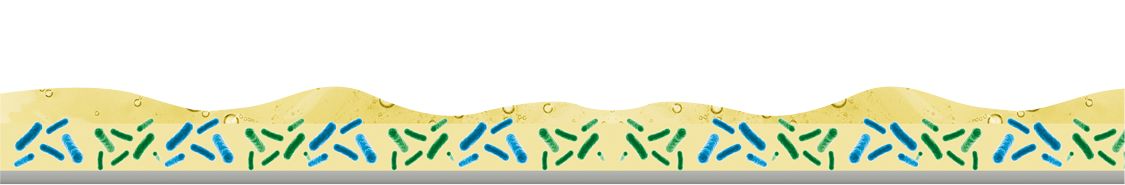
Les biofilms sont des communautés complexes de micro-organismes qui adhèrent aux surfaces et sont entourés d’une matrice de substances polymériques extracellulaires (EPS).
Les EPS jouent un rôle crucial dans la formation, la stabilité et la protection des biofilms.
En fonction des conditions environnementales, le biofilm peut être constitué de Listeria monocytogenes, Bacillus cereus et mycoïdes, Salmonella spp, Campylobacter, Pseudomonas aeruginosa, Leuconostoc ou Cronobacter (Enterobacter sakazakii) qui construisent la matrice du biofilm (polymères organiques, polysaccharides, protéines, ADN, lipides, etc.) et d’autres micro-organismes (pathogènes), des phages, des enzymes d’altération, des spores, des moisissures et des levures qui vivent à l’intérieur de la matrice.
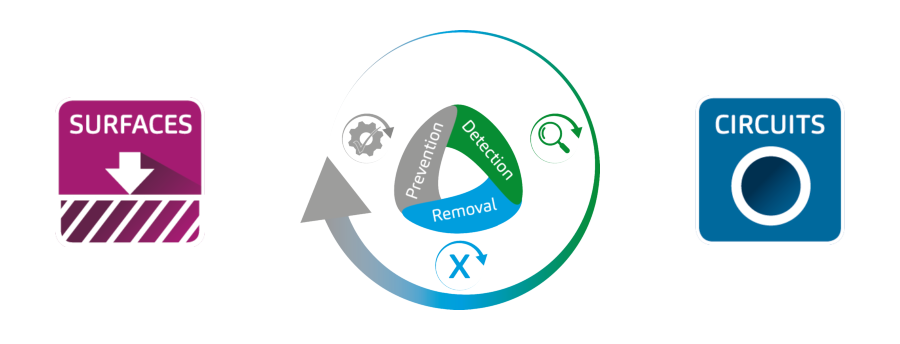
Grâce à cette structure, les biofilms sont plus résistants aux substances biocides que les mêmes bactéries dans un milieu liquide.
Cette construction complexe assure la survie des bactéries même dans des conditions extrêmes.