Biofilms: fuentes constantes de microorganismos y potenciales de patógenos
¿Qué son los biofilms?
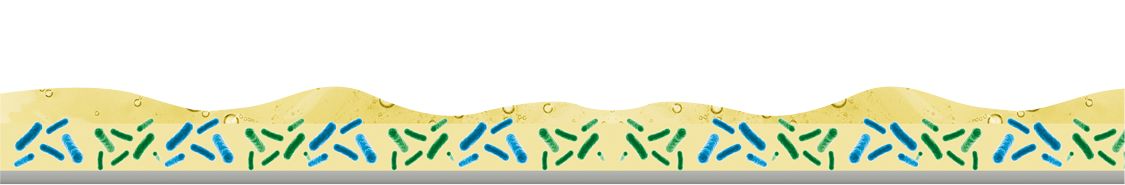
Los biofilms son comunidades complejas de microorganismos que viven adheridos a una superficie y que están rodeados por una matriz de sustancias poliméricas extracelulares (EPS, por sus siglas en inglés). Las sustancias poliméricas extracelulares desempeñan un papel muy importante en la formación, la estabilidad y la protección de los biofilms. En función de las condiciones ambientales, los biofilms pueden estar formados por las bacterias «Listeria monocytogenes», «Bacillus cereus» y «mycoïdes», «Salmonella spp.», «Campylobacter», «Pseudomonas aeruginosa», «Leuconostoc» o «Cronobacter» («Enterobacter sakazakii») que conforman la matriz del biofilm (polímeros orgánicos, polisacáridos, proteínas, ADN, lípidos, etc.) y otros microorganismos (patógenos), fagos, enzimas de alteración, esporas, mohos y levaduras que residen dentro de la matriz. Gracias a esta estructura, los biofilms son mucho más resistentes a las sustancias biocidas que las mismas bacterias en un medio líquido. Esta construcción tan compleja es lo que garantiza su supervivencia incluso en condiciones extremas.