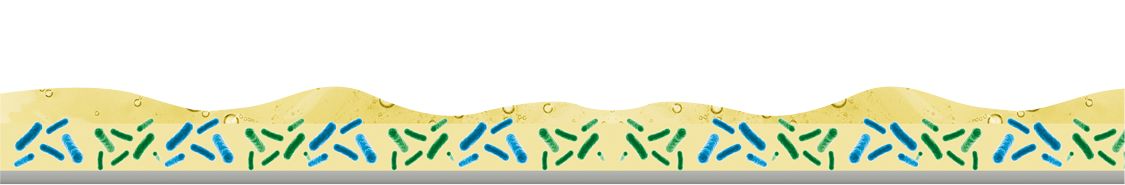
Biofilm – Dauerhafte Quelle von Mikroorganismen und potenziellen Pathogenen
Was sind Biofilme?
Biofilme sind komplexe Lebensgemeinschaften von Mikroorganismen, die sich an Oberflächen anheften und von einer Matrix extrazellulärer polymerer Substanzen (EPS) umgeben sind. Diese EPS spielen eine entscheidende Rolle bei der Bildung und Stabilität sowie beim Schutz von Biofilmen. In Abhängigkeit der Umgebungsbedingungen findet man in Biofilmen Listeria monocytogenes, Bacillus cereus und Bacillus mycoides, Salmonellen, Campylobacter, Pseudomonas aeruginosa, Leuconostoc und Cronobacter (Enterobacter sakazakii), die die Biofilm-Matrix bilden (organische Polymere, Polysaccharide, Proteine, DNA, Lipide usw.), sowie weitere (pathogene) Mikroorganismen, Phagen, Verderb auslösende Enzyme, Sporen, Schimmelpilze und Hefen, die in der Matrix leben. [1] Im Vergleich zu Bakterien in einem Flüssigmedium sind Biofilme dank dieser Struktur bis zu 1500 Mal widerstandsfähiger gegen biozide Substanzen. Im Vergleich zu Bakterien in einem Flüssigmedium sind Biofilme dank dieser Struktur wesentlich widerstandsfähiger gegen biozide Substanzen. Ihre komplexe Struktur sichert ihr Überleben selbst unter Extrembedingungen. [2]